Gases ideais
Nesta atividade experimental procura-se mostrar o comportamento dos gases ideais.Material:
- Um balão de borracha.
- Uma seringa grande sem a agulha.
Procedimento:
- Assopre o balão enchendo-o parcialmente e depois deixe o ar sair. Repita isso pelo menos por três vezes para as paredes de balão se tornar bem flexível, menos rígida.
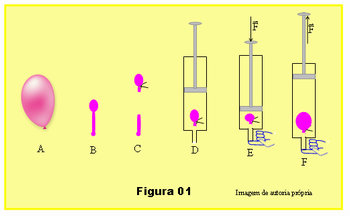
- Deixe sair boa parte do ar isolando apenas uma pequena parte formando um pequeno balão que deverá caber dentro da seringa, esquema B da Figura 01.
- Amarre um barbante isolando a parte cheia de ar, balãozinho, e corte as sobras da borracha, esquema C.
- Retire o êmbolo da seringa e coloque o balãozinho dentro da seringa. Veja que o diâmetro do balãozinho deve ser um pouco menor que o diâmetro da seringa, ou seja, ele cabe com folga dentro da seringa, esquema D, Figura 01.
- Tampe a extremidade da seringa com o dedo e empurra o êmbolo da seringa pressionando o ar dentro da seringa, esquema E da figura.
- Ainda com o dedo vedando a saída de ar na seringa, puxe o embolo para fora diminuindo a pressão no interior da seringa, esquema F, Figura 01.
Repita os procedimentos 5 e 6 várias vezes em diversos pontos da sala para que todos os alunos possam acompanhar e observar, sempre pedindo para notarem o que acontece com o balão no interior da seringa.
O professor deverá explicar aos alunos que o comportamento do balão corresponde ao comportamento do gás em seu interior; o uso do balão é para se tornar mais perceptivo aquilo que ocorre com o gás no interior da seringa, e que praticamente não houve variação temperatura no interior do balão.
Em seguida, pergunte para que respondam oralmente:
O que acontece com o volume do balão quando forçamos o êmbolo comprimindo o ar dentro da seringa?
E quando puxamos o êmbolo para fora, diminuindo a pressão no interior da seringa?
Então, que relação deve existir entre a pressão e o volume de um gás?
- Deverão ter observado que aumentando a pressão o volume diminui e diminuindo a pressão o volume do balão aumentou. Certamente dirão que o volume é inversamente proporcional à pressão.
Esta atividade foi extraída da aula Comportamento de Gases ideais, do professor José Ângelo de Faria - Viçosa/MG. Disponível no Portal do Professor/ MEC. Acessado em 13/07/2013. Todas as informações contidas são de responsabilidade do autor.

